I. KHÍ LÍ TƯỞNG (quan điểm vĩ mô)
Khí lí tưởng là chất khí tuân theo các định luật Boyle – Mariotte, Charles, Gay Lussac.
II. PHƯƠNG TRÌNH TRẠNG THÁI KHÍ LÍ TƯỞNG
Xét một khối khí lí tưởng biến đổi từ trạng thái 1 (p1, V1, T1) sang trạng thái 2 (p2, V2, T2) thông qua trạng thái trung gian 1′ (p’, V’, T’) sao cho T’ = T1 và V’ = V2.
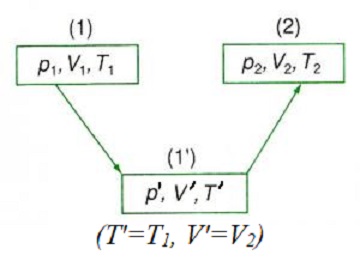
- Từ (1) → (1′) là quá trình đẳng nhiệt T’ = T1:
(*)
- Từ (1′) → (2) là quá trình đẳng tích V’ = V2:
(**)
(*) =>
(**) =>
Do đó:
(***)
Thay T’ = T1 và V’ = V2 vào (***) :
Vậy:
hằng số (const)
(phương trình trạng thái khí lí tưởng)
III. QUÁ TRÌNH ĐẲNG ÁP – ĐỊNH LUẬT CHARLES
3.1. Quá trình đẳng áp
Quá trình đẳng áp là quá trình biến đổi trạng thái trong đó áp suất không đổi.
3.2. Liên hệ giữa thể tích V và nhiệt độ tuyệt đối T trong quá trình đẳng áp (định luật Charles)
Ta có:
hằng số (const) với p = hằng số (const)
Do đó:
hằng số (const)
(định luật Charles)
3.1. Đường đẳng áp
Đường đẳng áp là đường biểu diễn sự biến thiên của thể tích theo nhiệt độ khi áp suất không đổi.
Do nên
(dạng y = a.x)
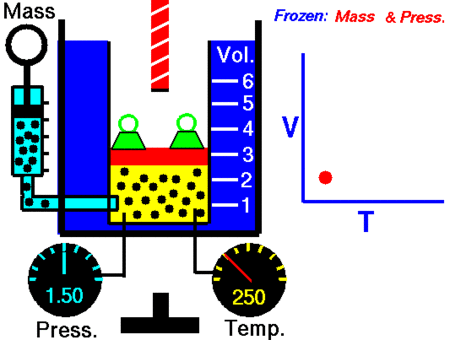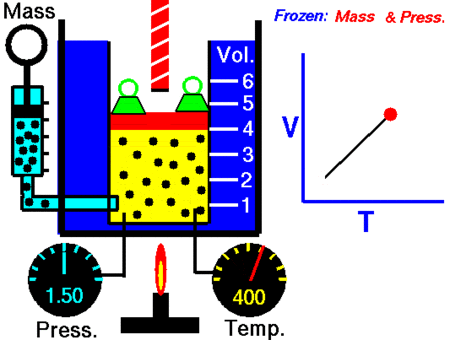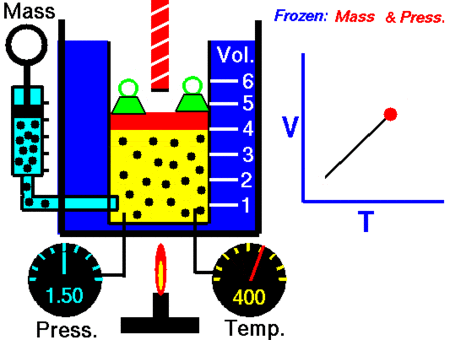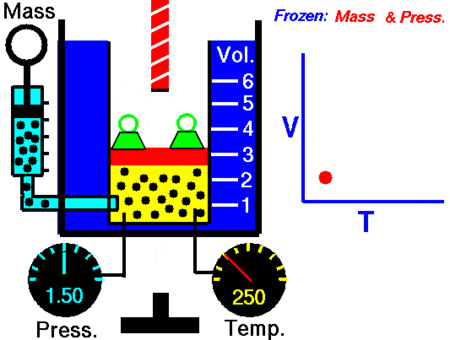
Trong hệ toạ độ (V, T), đường đẳng áp là đường thẳng có đường kéo dài đi qua gốc toạ độ.
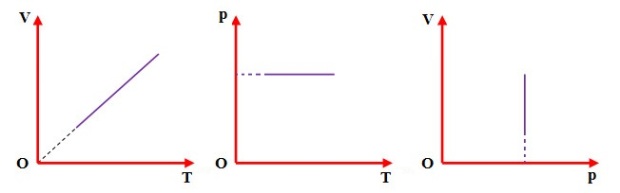
Đường đẳng áp trong các hệ tọa độ (V,T), (p,T), (V,p).
IV. TỔNG QUAN CÁC QUÁ TRÌNH BIẾN ĐỔI CỦA KHÍ LÍ TƯỞNG
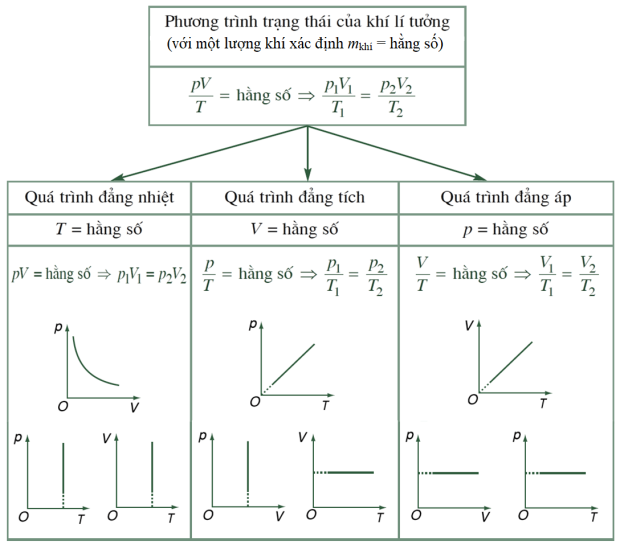
Phương trình trạng thái khí lí tưởng và các đẳng quá trình
V. BÀI TẬP MẪU
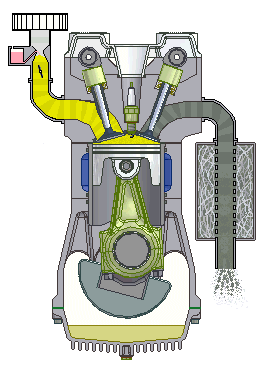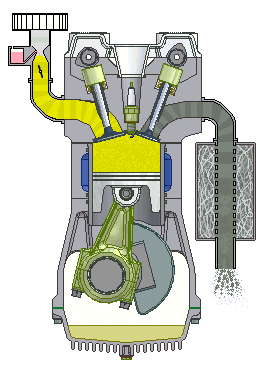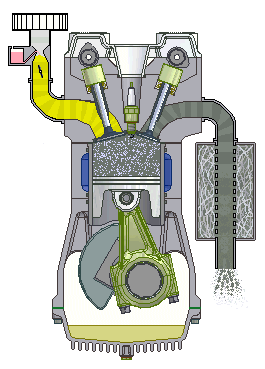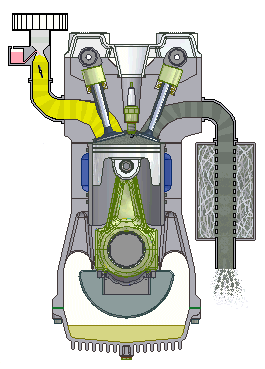
Động cơ đốt trong 4 kì
5.12. Trong xi-lanh của một động cơ đốt trong, hỗn hợp khí có áp suất 1 at, nhiệt độ 47oC, thể tích 4 dm3. Nén hỗn hợp khí đến thể tích 0,5 dm3 với áp suất 15 at. Tìm nhiệt độ của khí sau khi nén.
Tóm tắt
- Trạng thái 1 (khí trước khi nén):
p1 = 1 at.
t1 = 47oC => T1(K) = t1(oC)+ 273 = 320 K.
V1 = 4 dm3.
- Trạng thái 2 (khí sau khi nén):
p2 = 15 at.
V2 = 0,5 dm3.
t2 = ? oC
Áp dụng phương trình trạng thái khí lí tưởng:
Nhiệt độ khí sau khi nén:
t2 = T2 – 273 = 327oC.
5.14. Một lượng khí có áp suất 750 mmHg, nhiệt độ 27oC và thể tích 76 cm3. Tìm thể tích của khí ở điều kiện chuẩn (0oC, 760 mmHg).
ĐS: 68,25 cm3.